Mineralogi
Mineralogi
Bab akan menjelaskan gambaran umum mengenai mineralogi,
kimia mineral, sifat-sifat fisik mineral, dan sistematika mineral.
Mineral adalah zat atau benda yang biasanya padat dan homogen dan hasil
bentukan alam yang memiliki sifat-sifat fisik dan kimia tertentu serta umumnya
berbentuk kristalin. Meskipun demikian ada beberapa bahan yang terjadi
karena penguraian atau perubahan sisa-sisa tumbuhan dan hewan secara
alamiah juga digolongkan ke dalam mineral, seperti batubara, minyak bumi,
tanah diatome.
3.1 Kimia mineral
Kimia mineral merupakan suatu ilmu yang dimunculkan pada awal abad ke-
19,setelah dikemukakannya "hukum komposisi tetap" oleh Proust pada tahun
1799, teori atom Dalton pada tahun 1805, dan pengembangan metode analisis
kimia kuantitatif yang akurat. Karena ilmu kimia mineral didasarkan pada
pengetahuan tentang komposisi mineral, kemungkinan dan keterbatasan
analisis kimia mineral harus diketaui dengan baik. Analisis kimia kuantitatif
bertujuan untuk mengidentifikasi unsur-unsur yang menyusun suatu
substansi dan menentukan jumlah relatif masing-masing unsur tersebut.
Analisis harus lengkap .seluruh unsur-unsur yang ada pada mineral harus
ditentukan. dan harus tepat.
Komposisi kimia sebagian besar mineral yang diketahui, menunjukkan suatu
kisaran tertentu mengenai penyusun dasarnya. Dalam analisis kimia, jumlah
kandungan unsur dalam suatu senyawa dinyatakan dengan persen berat
dan dalam analisis yang lengkap jumlah total persentase penyusunnya harus
100. Namun dalam prakteknya, akibat keterbatasan ketepatan, jumlah 100
merupakan suatu kebetulan; umumnya kisaran 99,5 sampai 100,5 sudah dianggap
sebagai analisis yang baik.
Prinsip-prinsip kimia yang berhubungan dengan kimia mineral
1. Hukum komposisi tetap
(The Law of Constant Composition) oleh Proust (1799):
"Perbandingan massa unsur-unsur dalam tiap senyawa adalah tetap"
2. Teori atom Dalton (1805)
1. Setiap unsur tersusun oleh partikel yang sangat kecil dan berbentuk
seperti bola yang disebut atom.
a) Atom dari unsur yang sama bersifat sama sedangkan dari unsur
yang berbeda bersifat berbeda pula.
b) Atom dapat berikatan secara kimiawi menjadi molekul.
Teknik analisis mineral secara kimia
Analisis kimia mineral (dan batuan) diperoleh dari beberapa macam teknik
analisis. Sebelum tahun 1947 analisis kuantitatif mineral diperoleh dengan
teknik analisis "basah", yang mana mineral dilarutkan dalam larutan tertentu.
Penentuan unsur-unsur dalam larutan biasanya dipakai satu atau lebih teknikteknik
berikut: (1) ukur warna (colorimetry), (2) analisis volumetri (titrimetri)
dan (3) analisis gravimetri.
Sejak tahun 1960 sebagian besar analisis telah dilakukan dengan teknik instrumental
seperti spektroskop serapan atom, analisis flouresen sinar X, analisis
electron microprobe, dan spektroskop emisi optis. Masing-masing teknik
ini memiliki preparasi sampel yang khusus dan memiliki keterbatasan deteksi
dan kisaran kesalahan sedang - baik. Hasil analisis biasanya ditampilkan
dalam bentuk tabel persen berat dari unsur-unsur atau oksida dalam mineral
yang dianalisis. Teknik analisis basah memberikan determinasi secara kuantitatif
variasi kondisi oksidasi suatu kation (seperti Fe2+ dengan Fe3+) dan juga
untuk determinasi kandungan H2O dari mineral-mineral hidrous. Metode
instrumen umumnya tidak dapat memberikan informasi seperti kondisi oksidasi
atau kehadiran H2O.
Dalam analisis kimia mineral dapat dibedakan menjadi dua macam, yaitu
analisis kimia kualitatif dan analisis kimia kuantitatif. Analisis kualitatif
menyangkut deteksi dan identifikasi seluruh komposisi dari suatu senyawa.
Analisis kuantitatif meliputi penentuan persen berat (atau parts per million
[ppm]) unsur-unsur dalam suatu senyawa. Dengan demikian kedua analisis
ini akan menjawab pertanyaan "Apa yang dikandung dan berapa besar jumlahnya?".
Analisis kualitatif awal umumnya sangat membantu dalam memutuskan
metode apa yang akan dipakai untuk analisis kuantitatif.
Analisis kimia basah
Cara ini biasanya dilakukan di laboratorium kimia. Setelah sampel digerus
menjadi bubuk, langkah pertama yang dilakukan adalah menguraikan sampel.
Biasanya pada tahap ini digunakan satu dari beberapa larutan asam,
seperti asam klorida (HCl), asam sulfat (H2SO4), atau asam florida (HF), atau
campuran dari larutan asam tersebut. Jika sampel sudah dalam bentuk larutan,
langkah selanjutnya adalah colorimetry, volumetri atau gravimetri untuk
menentukan unsur-unsur yang diinginkan.
Kisaran konsentrasi unsur-unsur berdasarkan teknik analisis ini adalah:
Metode Konsentrai unsur dalam sampel
Gravimetri rendah - 100%
Volumetri rendah - 100%
Colorimetri ppm - rendah
Keuntungan menggunakan cara basah adalah reaksi dapat terjadi dengan
cepat dan relatif mudah untuk dikerjakan.
Analisis serapan atom (AAS)
AAS (atomic absorption spectroscopy) ini dapat dimasukkan dalam analisis kimia
cara basah karena sampel asli yang akan dianalisis secara sempurna terlarutkan
dalam suatu larutan sebelum dilakukan analisis. Cara ini didasarkan
atas pengamatan panjang gelombang yang dipancarkan suatu unsur atau serapan
suatu panjang gelombang oleh suatu unsur. Dalam perkembangannya
yang terakhir alat ini dilengkapi oleh inductively coupled plasma (ICP) dan
metode ICP-mass spectrometric (ICP-MS).
Sumber energi yang digunakan pada teknik ini adalah lampu katoda dengan
energi berkisar antara cahaya tampak sampai ultraviolet dari spektrum
elektromagnetik. Sampel dalam bentuk larutan dipanas-kan, dengan anggapan
atom-atom akan bebas dari ikatan kimianya. Pada sampel panas dilewatkan
sinar katoda, akan terjadi penyerapan energi yang akan terekam
dalam spektrometer.
Analisis fluoresen sinar X (XRF)
Analisis ini juga dikenal dengan spektrografi emisi sinar X, yang banyak digunakan
untuk laboratorium penelitian yang mempelajari kimia substansi anorganik.
Di samping untuk laboratorium penelitian analisis ini juga digunakan
untuk keperluan industri, seperti: industri tambang (untuk kontrol kualitas
hasil yang akan dipasarkan), industri kaca dan keramik, pabrik logam dan
bahan baku logam, dan dalam perlindungan lingkungan dan pengawasan pulusi.
Pada analisis ini sampel digerus menjadi bubuk dan ditekan dalam bentuk
pelet bundar. Pelet ini nantinya akan ditembak dengan sinar X. Spektrum
emisi sinar X yang dihasilkan merupakan ciri-ciri tiap-tiap unsur yang terkandung
dalam sampel.
Analisis ini dapat digunakan untuk penentuan sebagian besar unsur, dan
juga sangat sensitif untuk penentuan secara tepat beberapa unsur jejak (seperti
Y, Zr, Sr, Rb dalam kisaran ppm).
Electron probe microanalysis
Metode ini didasarkan atas prinsip yang sama dengan analisis fluoresen sinar
X, kecuali energi yang dipakai bukan tabung sinar X tetap digantikan oleh
sinar elektron. Disebut mikroanalisis karena dapat menganalisis baik kualitatif
maupun kuantitatif material dalam jumlah yang sangat sedikit. Sampel
yang dianalisis biasanya berbentuk sayatan yang sudah dikilapkan (polished
section atau polished thin section) dari suatu mineral, batuan atau material
padat yang lain.
Volume minimum yang dapat dianalisis dengan metode ini sekitar 10 sampai
20 fim3, yang dalam satuan berat sekitar 10-11 gram (untuk material silikat).
Analisis spektrografik optis
Spektrograif emisi optik didasarkan pada kenyataan bahwa atom suatu unsur
dapat menghasilkan energi. Ketika energi ini terdispersi, dengan menggunakan
prisma dapat direkam sebagai suatu spektrum. Jumlah garis dan intensitas
garis dalam spektrum yang terekam ditentukan oleh konfigurasi atom.
Analisis kuantitatif dengan teknik ini memerlukan pengukuran terhadap ketajaman
dari garis-garis spektral yang terekam dalam fotograf.
3.2 Sifat-sifat fisik mineral
Penentuan nama mineral dapat dilakukan dengan membandingkan sifat-sifat
fisik mineral antara mineral yang satu dengan mineral yang lainnya. Sifat-sifat
fisik mineral tersebut meliputi: warna, kilap (luster), kekerasan (hardness), cerat
(streak), belahan (cleavage), pecahan (fracture), struktur/bentuk kristal, berat
jenis, sifat dalam (tenacity), dan kemagnetan.
Warna adalah kesan mineral jika terkena cahaya. Warna mineral dap20
at dibedakan menjadi dua, yaitu idiokromatik, bila warna mineral selalu
tetap, umumnya dijumpai pada mineral-mineral yang tidak tembus cahaya
(opak), seperti galena, magnetit, pirit; dan alokromatik, bila warna mineral
tidak tetap, tergantung dari material pengotornya. Umumnya terdapat pada
mineral-mineral yang tembus cahaya, seperti kuarsa, kalsit.
Kilap adalah kesan mineral akibat pantulan cahaya yang dikenakan
padanya. Kilap dibedakan menjadi dua, yaitu kilap logam dan kilap bukanlogam.
Kilap logam memberikan kesan seperti logam bila terkena cahaya.
Kilap ini biasanya dijumpai pada mineral-mineral yang mengandung logam
atau mineral bijih, seperti emas, galena, pirit, kalkopirit. Kilap bukan-logam
tidak memberikan kesan seperti logam jika terkena cahaya. Kilap jenis ini dapat
dibedakan menjadi:
_ Kilap kaca (vitreous luster)
memberikan kesan seperti kaca bila terkena cahaya, misalnya: kalsit,
kuarsa, halit.
_ Kilap intan (adamantine luster)
memberikan kesan cemerlang seperti intan, contohnya intan
_ Kilap sutera (silky luster)
memberikan kesan seperti sutera, umumnya terdapat pada mineral yang
mempunyai struktur serat, seperti asbes, aktinolit, gipsum
_ Kilap damar (resinous luster)
memberikan kesan seperti damar, contohnya: sfalerit dan resin
_ Kilap mutiara (pearly luster)
memberikan kesan seperti mutiara atau seperti bagian dalam dari kulit
kerang, misalnya talk, dolomit, muskovit, dan tremolit.
_ Kilap lemak (greasy luster)
menyerupai lemak atau sabun, contonya talk, serpentin
_ Kilap tanah
kenampakannya buram seperti tanah, misalnya: kaolin, limonit, bentonit.
Kekerasan adalah ketahanan mineral terhadap suatu goresan. Secara relatif
sifat fisik ini ditentukan dengan menggunakan skala Mohs, yang dimulai dari
skala 1 yang paling lunak hingga skala 10 untuk mineral yang paling keras.
Skala Mohs tersebut meliputi (1) talk, (2) gipsum, (3) kalsit, (4) fluorit, (5) apatit,
(6) feldspar, (7) kuarsa, (8) topaz, (9) korundum, dan (10) intan.
Cerat adalah warna mineral dalam bentuk bubuk. Cerat dapat sama atau
berbeda dengan warna mineral. Umumnya warna cerat tetap. Belahan
adalah kenampakan mineral berdasarkan kemampuannya membelah melalui
bidang-bidang belahan yang rata dan licin (Gambar 3.1). Bidang belahan
umumnya sejajar dengan bidang tertentu dari mineral tersebut.
Pecahan adalah kemampuan mineral untuk pecah melalui bidang yang
tidak rata dan tidak teratur. Pecahan dapat dibedakan menjadi: (a) pecahan
konkoidal, bila memperlihatkan gelombang yang melengkung di permukaan
(Gambar 3.2); (b) pecahan berserat/fibrus, bila menunjukkan kenampakan
seperti serat, contohnya asbes, augit; (c) pecahan tidak rata, bila memperlihatkan
permukaan yang tidak teratur dan kasar, misalnya pada garnet;
(d) pecahan rata, bila permukaannya rata dan cukup halus, contohnya: mineral
lempung; (e) pecahan runcing, bila permukaannya tidak teratur, kasar,
dan ujungnya runcing-runcing, contohnya mineral kelompok logam murni;
(f) tanah, bila kenampakannya seperti tanah, contohnya mineral lempung.
Bentuk mineral dapat dikatakan kristalin, bila mineral tersebut mempunyai
bidang kristal yang jelas dan disebut amorf, bila tidak mempunyai batasbatas
kristal yang jelas. Mineral-mineral di alam jarang dijumpai dalam bentuk
kristalin atau amorf yang ideal, karena kondisi pertumbuhannya yang biasanya
terganggu oleh proses-proses yang lain. Srtruktur mineral dapat dibagi
menjadi beberapa, yaitu:
_ Granular atau butiran: terdiri atas butiran-butiran mineral yang mempunyai
dimensi sama, isometrik.
_ Struktur kolom, biasanya terdiri dari prisma yang panjang dan bentuknya
ramping. Bila prisma tersebut memanjang dan halus, dikatakan
mempunyai struktur fibrus atau berserat.
GAMBAR 3.1: Belahan tiga arah pada gipsum yang dihasilkan dari fragmen semirombohedral
(Hibbard, 2002)
GAMBAR 3.2: Pecahan konkoidal pada beril (Hibbard, 2002
_ Struktur lembaran atau lamelar, mempunyai kenampakan seperti lembaran.
Struktur ini dibedakan menjadi: tabular, konsentris, dan foliasi.
_ Struktur imitasi, bila mineral menyerupai bentuk benda lain, seperti
asikular, filiformis, membilah, dll.
Sifat dalam merupakan reaksi mineral terhadap gaya yang mengenainya,
seperti penekanan, pemotongan, pembengkokan, pematahan, pemukulan
atau penghancuran. Sifat dalam dapat dibagi menjadi: rapuh (brittle), dapat
diiris (sectile), dapat dipintal (ductile), dapat ditempa (malleable), kenyal/lentur
(elastic), dan fleksibel (flexible).
3.3 Sistematika mineral
Sistematika atau klasifikasi mineral yang biasa digunakan adalah klasifikasi
dari Dana, yang mendasarkan pada kemiripan komposisi kimia dan struktur
kristalnya. Dana membagi mineral menjadi delapan golongan (Klein & Hurlbut,
1993), yaitu:
1. Unsur murni (native element), yang dicirikan oleh hanya memiliki satu
unsur kimia, sifat dalam umumnya mudah ditempa dan/atau dapat dipintal,
seperti emas, perak, tembaga, arsenik, bismuth, belerang, intan,
dan grafit.
2. Mineral sulfida atau sulfosalt, merupakan kombinasi antara logam atau
semi-logam dengan belerang (S), misalnya galena (PbS), pirit (FeS2),
proustit (Ag3AsS3), dll
3. Oksida dan hidroksida, merupakan kombinasi antara oksigen atau
hidroksil/air dengan satu atau lebih macam logam, misalnya magnetit
(Fe3O4), goethit (FeOOH).
4. Haloid, dicirikan oleh adanya dominasi dari ion halogenida yang elektronegatif,
seperti Cl, Br, F, dan I. Contoh mineralnya: halit (NaCl), silvit
(KCl), dan fluorit (CaF2).
5. Nitrat, karbonat dan borat, merupakan kombinasi antara logam/semilogam
dengan anion komplek, CO3 atau nitrat, NO3 atau borat
(BO3). Contohnya: kalsit (CaCO3), niter (NaNO3), dan borak
(Na2B4O5(OH)4 . 8H2O).
6. Sulfat, kromat, molibdat, dan tungstat, dicirikan oleh kombinasi logam
dengan anion sulfat, kromat, molibdat, dan tungstat. Contohnya: barit
(BaSO4), wolframit ((Fe,Mn)Wo4)
7. Fosfat, arsenat, dan vanadat, contohnya apatit (CaF(PO4)3), vanadinit
(Pb5Cl(PO4)3)
8. Silikat, merupakan mineral yang jumlah meliputi 25% dari keseluruhan
mineral yang dikenal atau 40% dari mineral yang umum dijumpai.
Kelompok mineral ini mengandung ikatan antara Si dan O. Contohnya:
kuarsa (SiO2), zeolit-Na (Na6[(AlO2)6(SiO2)30] . 24H2O).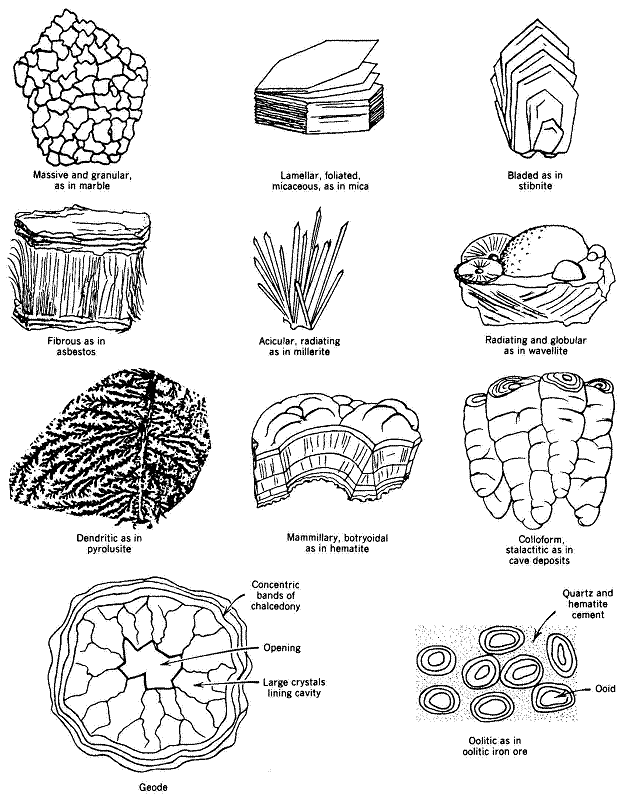
GAMBAR 3.3: Beberapa kebiasaan mineral dan asal mulanya (Klein & Hurlbut, 1993)